- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn
Recrutement
La microscopie non-linéaire est une technique largement répandue pour l'imagerie 3D dans les tissus biologiques : un laser pulsé est focalisé dans l'échantillon pour induire un effet non-linéaire (tel que la fluorescence excitée à deux photons, la génération de seconde ou de troisième harmonique) dans une région confinée autour du point focal, puis ce dernier est balayé pour former une image 3D. Grâce à l'utilisation de longueurs d'onde proche infrarouge et du confinement intrinsèque du volume excité, la microscopie non-linéaire permet de voir à l’intérieur de tissus épais et diffusants.
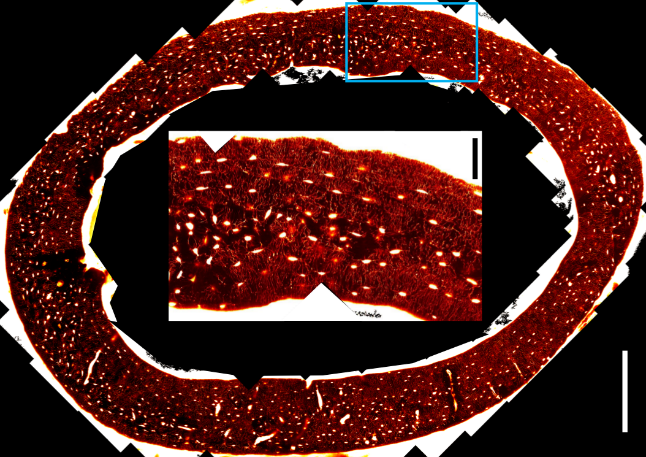
Au laboratoire LIPhy, nous nous intéressons à la structure des tissus minéralisés, tels que les os et les dents, à différentes échelles spatiales. La microscopie optique est bien adaptée à l’étude de l'organisation des réseaux cellulaires dans les tissus osseux. Cependant, pour comprendre la structure à l’échelle de l’organe, il est important d’imager de grands champs de vue (cm) et de pouvoir corréler les images obtenues par différentes modalités (telles que rayons X ou IRM). Dans la plupart des microscopes non-linéaires, le faisceau laser est balayé à l’aide de miroirs galvanométriques : une déviation angulaire du faisceau est transformée par le système optique (en particulier, l’objectif de microscope) en translation du point focal. Ainsi, le système optique limite la taille du champ de vue et crée des distorsions dans ce champ. Bien qu'il soit possible d'assembler plusieurs images pour obtenir une zone plus large (voir figure), le recalage d'images provenant de différentes modalités est rendu imprécis par la présence de distorsions.
Ce projet a pour but de développer un microscope non-linéaire reposant sur une méthode originale de balayage. En effet, l’utilisation de moteurs linéaires (pour déplacer l’échantillon) permet d’imager de grands champs de vue, indépendamment du système optique. Cependant, leur vitesse étant relativement lente, l’acquisition d’une pile d’images 2D prendrait un temps rédhibitoire. Nous proposons donc de combiner ces moteurs avec un balayage axial rapide permettant d’acquérir une colonne de l’échantillon en chaque point (x,y). Ce balayage est effectué par une lentille à gradient acoustique dont la distance focale varie à une fréquence de 70 kHz.
Ce stage aura pour objectifs, à partir d’un montage optique existant, de le tester et d’optimiser les paramètres de contrôle des moteurs et d’acquisition des signaux. Le travail portera également sur la reconstruction des volumes 3D à partir des signaux acquis. Enfin, nous réaliserons des images de tissus minéralisés, en détectant la fluorescence excitée à deux photons et la génération de second-harmonique.
Nous recherchons un étudiant avec une formation en optique et en physique et un intérêt particulier pour le développement instrumental et le traitement d’images. Une expérience en programmation Python serait appréciée.
Contact
Irène Wang
Équipe IMOV
+33 4 76 51 47 29
irene.wang univ-grenoble-alpes.fr (irene[dot]wang[at]univ-grenoble-alpes[dot]fr)
univ-grenoble-alpes.fr (irene[dot]wang[at]univ-grenoble-alpes[dot]fr)
Aurélien Gourrier
Équipe IMOV
+33 4 76 63 58 01
aurelien.gourrier univ-grenoble-alpes.fr (aurelien[dot]gourrier[at]univ-grenoble-alpes[dot]fr)
univ-grenoble-alpes.fr (aurelien[dot]gourrier[at]univ-grenoble-alpes[dot]fr)
- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn