- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn
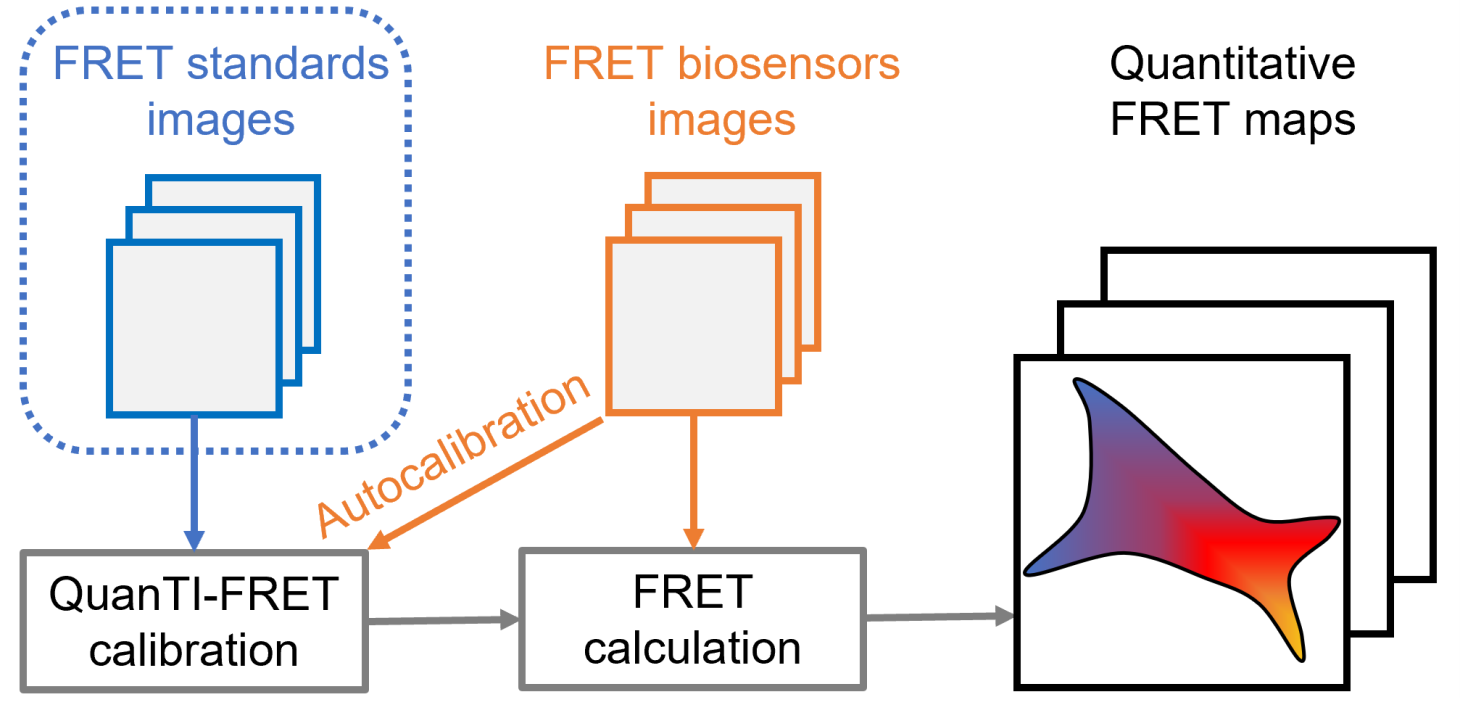
Il est difficile de mesurer l'activité biochimique d'une protéine dans une cellule vivante de manière résolue dans l'espace et dans le temps. C’est impossible avec les méthodes classiques de biologie moléculaire, mais de nouveaux outils ont récemment fait leur apparition, à savoir les biosenseurs fluorescents. La plupart d'entre eux sont basés sur le principe de « Förster Resonance Energy Transfer » (FRET), c'est-à-dire le transfert d'énergie entre deux fluorophores permettant de sonder des distances de l'ordre de quelques nanomètres et donc des changements de conformation des protéines. Ces biosenseurs ont un potentiel énorme, mais leur développement est entravé d'une part par la difficulté à les mettre au point et d'autre part par la difficulté à mesurer le FRET de manière fiable dans les cellules vivantes. Pour lever cette difficulté, nous avons développé, en collaboration avec l'équipe de Don Lamb (LMU Munich), une nouvelle méthode d'étalonnage qui permet de mesurer les valeurs FRET absolues et ouvre ainsi la voie à de nouvelles expériences. De plus, cette méthode donne accès à la stœchiométrie relative entre les fluorophores donneurs et accepteurs et permet donc la mesure quantitative des biosenseurs FRET intermoléculaires (où la stœchiométrie n'est pas fixe). Cette méthode est accessible via un code Python ouvert (https://gricad-gitlab.univ-grenoble-alpes.fr/liphy/quanti-fret) et un plugin pour le logiciel libre Napari (https://napari-hub.org/plugins/quanti-fret.html).
Responsables
- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn