- Imprimer
- Partager
- Partager sur Facebook
- Share on X
- Partager sur LinkedIn
Microscopie à des forces de tractions
Objectif :
Mesurer les forces exercées par des cellules sur leur environnement.
Mise en œuvre :
La cellule est déposée sur un hydrogel déformable, dopé avec des traceurs fluorescents, dont les déplacements sont suivis par microscopie de fluorescence (Figure 3). L’analyse de ces déplacements donne accès aux déformations locales de l'environnement, et de manière indirecte, aux forces exercées par les cellules.
Référence :
Lafaurie-Janvore, J. et al. ESCRT-III Assembly and Cytokinetic Abscission Are Induced by Tension Release in the Intercellular Bridge. Science (80-. ). 339, 1625–1629 (2013).
Soft Patterning
Objectif :
Contrôler simultanément la géométrie et les propriétés mécaniques de l'environnement cellulaire, afin de manipuler l'adhésion, l'étalement et l'architecture cellulaire.
Mise en œuvre :
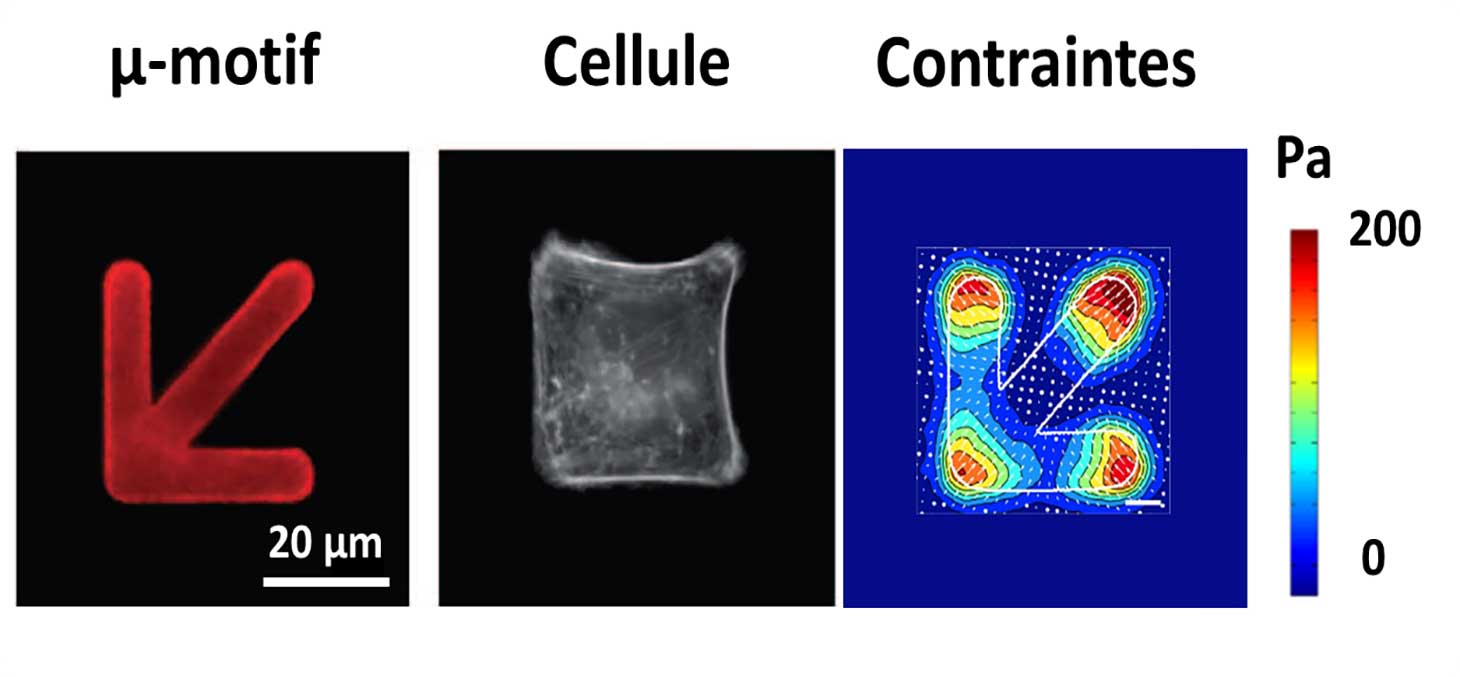
Un motif biochimique est imprimé par photolithographie sur l'hydrogel déformable, afin d'alterner des zones adhésives et des zones répulsives pour les cellules. La taille et la géométrie du motif sont choisies par l’expérimentateur et le motif est répliqué un grand nombre de fois pour multiplexer l’expérience sur de nombreuses cellules.
Types d’observation :
Les cellules adaptent leur géométrie au motif imposé, induisant ainsi une réorganisation structurelle et fonctionnelle. Cette réorganisation est mesurable par vidéo-microscopie optique et par microscopie des forces de traction (Figure 3). Plusieurs cellules en interaction entre elles peuvent être logées sur un même motif, pour étudier la propagation des signaux biologiques et mécaniques entre cellules voisines.
Référence :
Tseng, Q. et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip 11, 2231–2240 (2011).
Micro-tissus
Objectif :
Créer des tissus tridimensionnels auto-organisés et fonctionnels.
Mise en œuvre :
MicroTiss développe des techniques permettant de générer des tissus 3D libres (sphéroides) ou contraints (microtissus). La première méthode consiste à cultiver les cellules sur un substrat répulsif, ce qui favorise la formation spontanée d’un agrégat multicellulaire sphérique. La deuxième méthode consiste à déposer un mélange de cellules et de matrice extracellulaire dans une micro-chambre de culture, en présence de piliers déformables (Figure 4). Dans ce cas, les cellules s’auto-organisent pour former un micro-tissu 3D, suspendu aux piliers.
Types d’observation :
La formation des micro-tissus est observable en temps réel par vidéo-microscopie, dans différentes conditions expérimentales (type, nombre et âge des cellules, type et densité de la matrice extracellulaire, …). Les piliers étant déformables et de rigidité connue, leur déflexion indique en temps réel les forces générées par le micro-tissu.
Référence :
Boudou, T. et al. A Microfabricated Platform to Measure and Manipulate the Mechanics of Engineered Cardiac Microtissues. Tissue Eng. Part A 18, 910–919 (2012).
Ramade, A., Legant, W. R., Picart, C., Chen, C. S. & Boudou, T. Microfabrication of a Platform to Measure and Manipulate the Mechanics of Engineered Microtissues. in Methods in Cell Biology (ed. Théry, M. P. and M.) 121, 191–211 (Elsevier Inc., 2014).

Micro-senseurs de pression
Objectif :
Mesurer la contrainte mécanique à l’intérieur d’un tissu tridimensionnel.
Mise en œuvre :
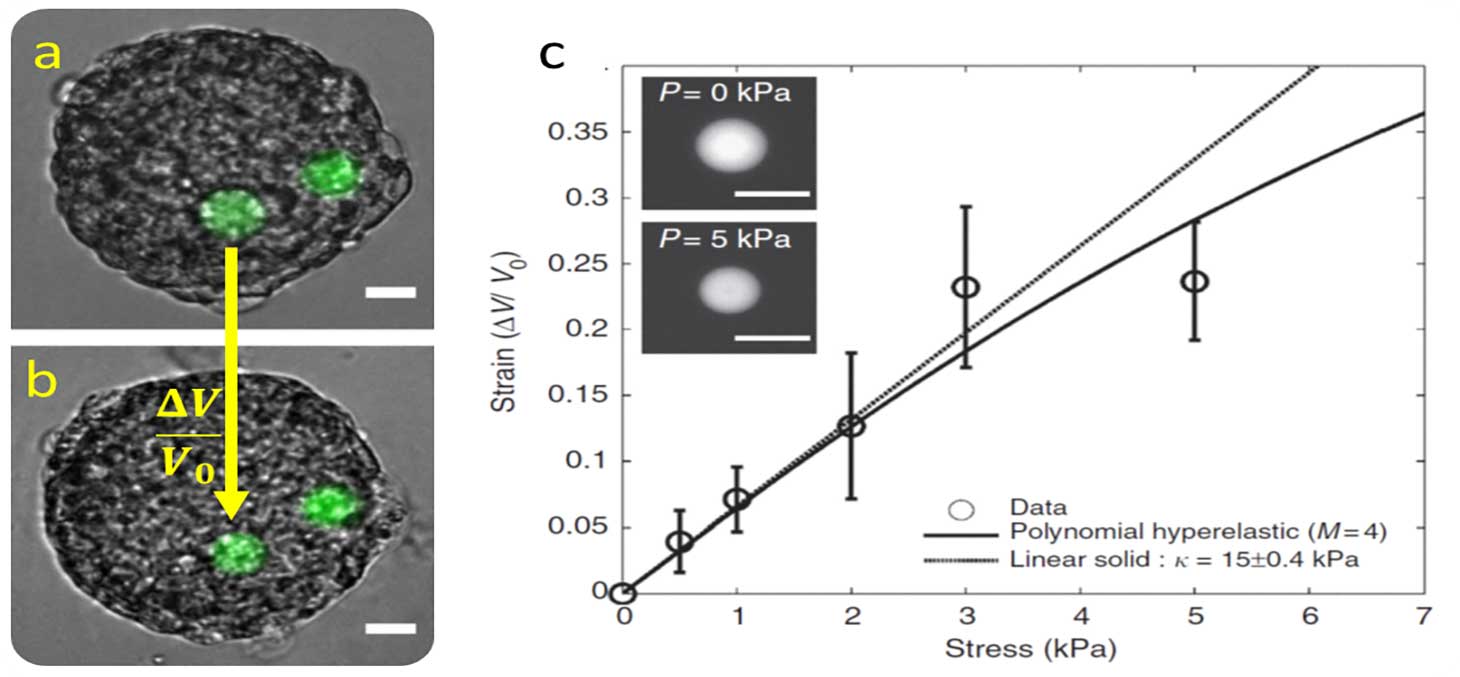
Nous réalisons des micro-senseurs de pression qui miment la taille, la rigidité et l’état de surface d’une cellule. Grâce à ces caractéristiques, le micro-senseur est incorporé spontanément par les tissus biologiques.
Mesure du stress :
Les micro-senseurs sont des billes de polyacrylamide, déformables de fluorescentes. A partir des observations par microscopie de fluorescence, la déformation occasionnée par le tissu est quantifiée. Une courbe de calibration universelle permet de relier cette déformation à la contrainte que le tissu exerce sur la bille (Figure 5).
Référence :
Dolega et al.; “Cell-like pressure sensors reveal increase of mechanical stress towards the core of multicellular spheroids under compression”; Nature Comm. (2017)
Contrôle de la contractilité par optogénétique
Objectif :
Moduler la contractilité cellulaire dans le temps et dans l’espace.
Mise en œuvre :
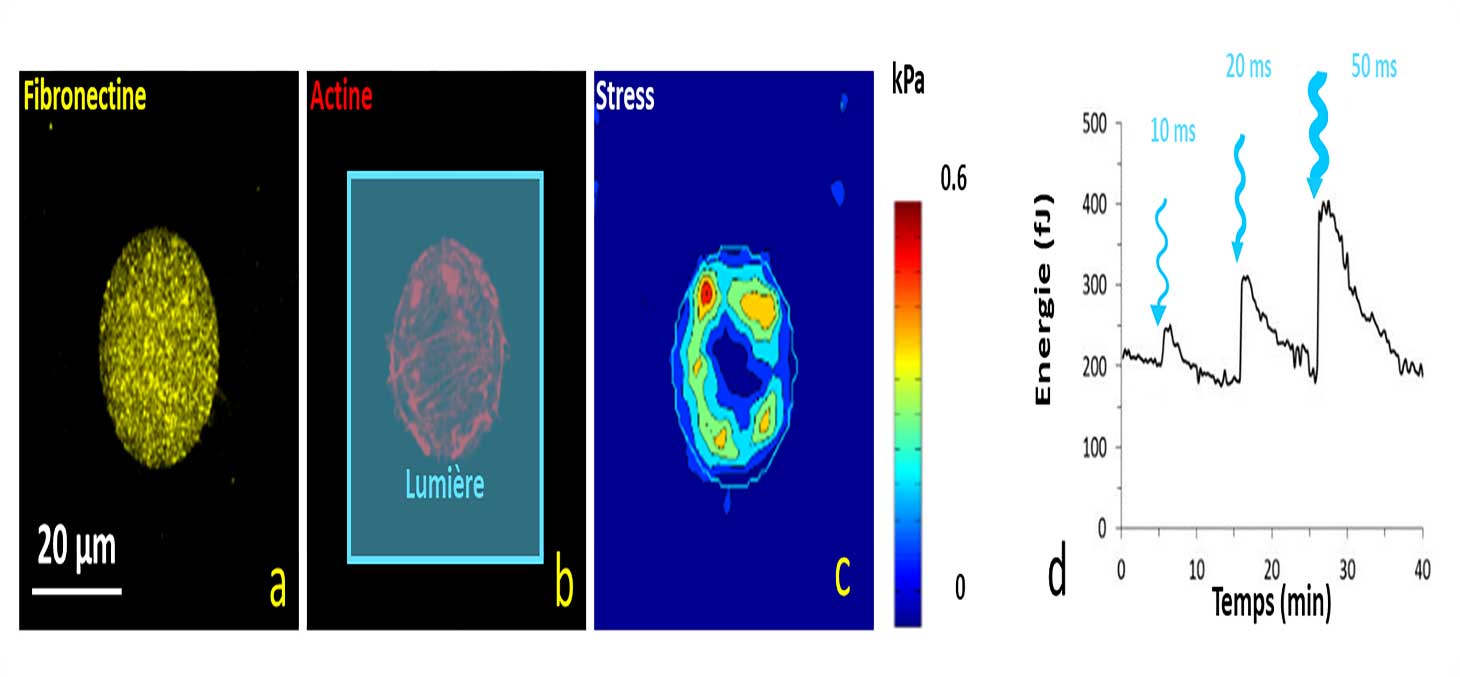
L’utilisation de drogues – telles que la blebbistatine – permet d’affecter la contractilité cellulaire. L’utilisation de cellules génétiquement modifiées ajoute la possibilité de moduler leur contractilité localement dans l’espace et dans le temps.
Contrôle de la contractilité par la lumière :
Lorsque les cellules optogénétiquement modifiées sont éclairées par une lumière bleue, leur contractilité augmente sensiblement. La Figure 6 montre un exemple de cellule qui se contracte suite à des périodes d’éclairages. L’amplitude de l’effet est proportionnelle à l’énergie de l’impulsion lumineuse.
Référence :
1. Andersen, T. et al. Cell size and actin architecture determine force generation in optogenetically activated adherent cells. bioRxiv (2022).
Méry, A. et al. Light-driven biological actuators to probe the rheology of 3D microtissues. BioRxiv (2022). doi:10.1101/2022.01.05.475039
Hennig, K. et al. Stick-slip dynamics of cell adhesion triggers spontaneous symmetry breaking and directional migration of mesenchymal cells on one-dimensional lines. Sci. Adv. 6, eaau5670 (2020).
Diffusion dynamique de la lumière
Objectif :
Quantifier la dynamique cellulaire dans un tissu tridimensionnel opaque.
Problématique :
Les cellules sont des objets diffusants. Ceci rend opaques les tissus épais, où il est difficile de réaliser des observations au-delà des premières couches cellulaires. Cependant, les photons diffus ayant interagi avec les cellules portent tout de même de l’information qui peut être exploitée.
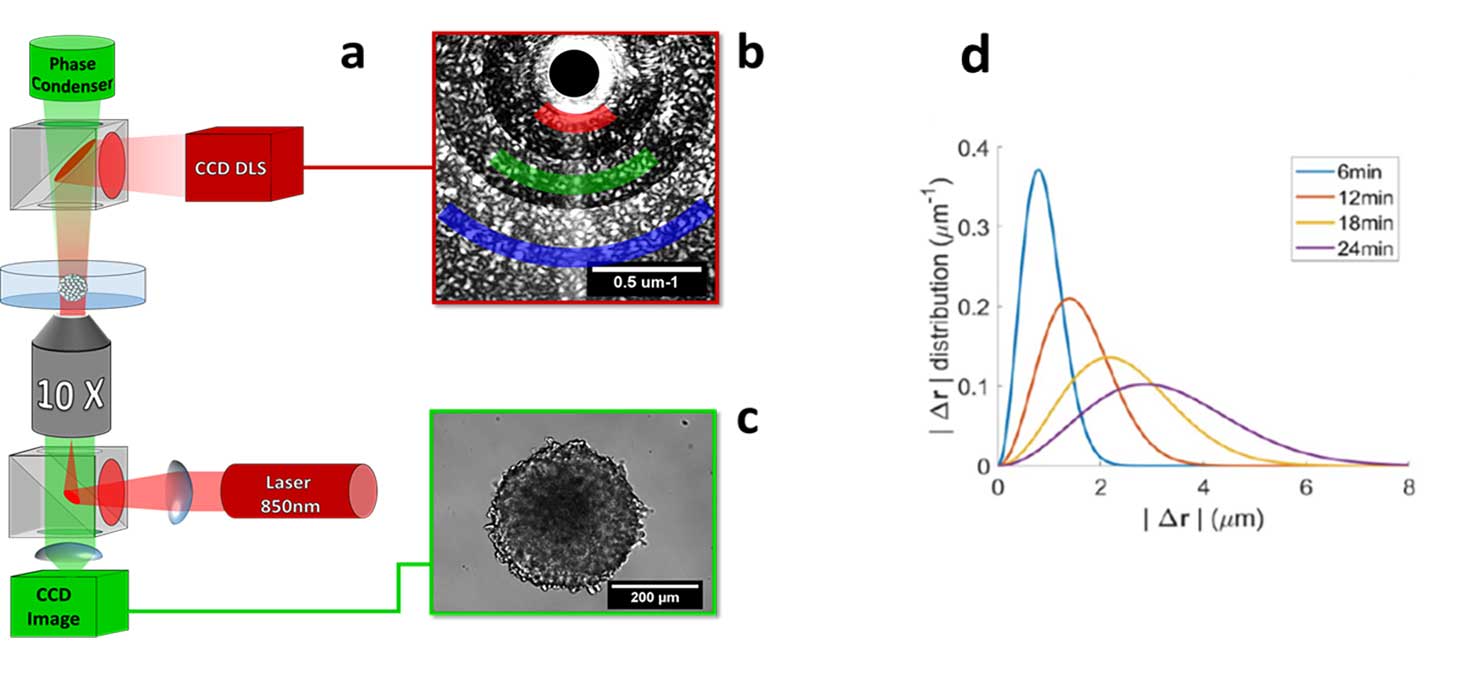
Diffusion de la lumière et interférence dynamique :
Lorsqu’ils sont éclairés par une source cohérente, les tissus 3D produisent une figure d’interférence, qui varie dans le temps. En analysant la dynamique de cette figure d’interférence, il est possible de reconstruire la distribution spatiale et le champ de vitesse des cellules à l’intérieur du tissu.
Référence :
B Brunel et al., “Structure and dynamics of multicellular assemblies measured by coherent light scattering”, New Journal of Physics (2017)
- Imprimer
- Partager
- Partager sur Facebook
- Share on X
- Partager sur LinkedIn